Comportamiento Electroquímico de Impurezas en Efluentes de Electrólisis de Cobre
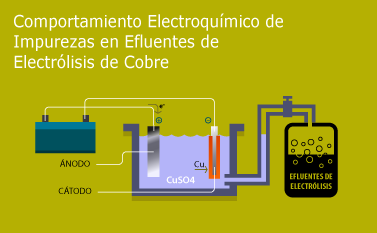
El estudio del comportamiento electroquímico del cobre nos permite identificar y caracterizar en forma parcial la naturaleza de la solubilidad ionica acuosa de impurezas presentes en la masa de los cuerpos mineralizados de los materiales metálicos de especies minerales de cobre y a partir de ello obtener secuencias en la identificación y caracterización de efluentes de la actividad hidrometalúrgica a partir de minerales con valores en cobre.
La caracterización de un mineral con abundante constitución de sulfuros permitió efectuar la lixiviación bajo condiciones semi estandarizadas en procesos industriales, logrando la extracción de alrededor del 87% de cobre en 8 horas de lixiviación previa una tostación del mineral a 500 °C. El análisis de contenido es determinado por la técnica del ICP lográndose altas disoluciones de hierro, cobre, plata, plomo y zinc.
Habiendo agotado el electrolito principal, el cobre; la solución efluente pobre es sometida al agotamiento mediante electrodos auxiliares, lográndose una solución residual conteniendo elementos muy cercanos a los límites permisibles para efluentes líquidos.
I. INTRODUCCIÓN
Históricamente se han utilizado los procesos físicos y químicos para el tratamiento de efluentes industriales. Luego de la masificación de los procesos industriales, se ha trabajado arduamente para contrarrestar el impacto negativo sobre el medio ambiente, obteniéndose resultados muy confidenciales y dispersos que no satisfacen las necesidades del sector productivo contemporáneo.
Hoy en día, es de primordial importancia planificar el tratamiento de efluentes, en forma paralela al proceso de construción de la planta de producción, y en cumplimiento a las normativas ambientales vigentes (Lovera, D. 1999).
Por ello es imprescindible la identificación de las variables químicas para lograr el abatimiento de los elementos presentes en los productos finales, es decir, los procesos "End of Pipe" o al final de la línea.
A pesar de que las rutas tecnológicas para procesar un material residual son de diversa índole, en nuestro medio no se han efectuado estudios exhaustivos para el tratamiento de los efluentes líquidos provenientes de las plantas de concentración y refinación de cobre.
Dado el ritmo actual del avance del desarrollo tecnológico y teniendo en cuenta la misión institucional, nos vemos en la obligación de estar en la búsqueda y creación constante de nuevas formas del conocimiento y su interpretación cuasi comparativa con las tradicionales formas de hallar las propiedades físicas y químicas de los metales los cuales no tienen ninguna representación del proceso productivo.
La identificación y caracterización plena nos ayudará a buscar la optimización de los procesos productivos en armonía con el entorno ecológico y de la sostenibilidad.
II. ANTECEDENTES
En la diversidad de estudios para medir, reducir y tratar los efluentes de procesos industriales, buscando identificar la aplicación de uno u otro método para reducir los elementos presentes conocidos como recuperables económicamente y otros considerados como impurezas o contaminantes para el medio ambiente.
La precipitación química con sulfuro de sodio y luego un proceso de adsorción mediante resinas de intercambio iónico fue abordado por L. Puente (1995), llegando a la determinación de parámetros que conllevan a la obtención de efluentes dentro de los límites permisibles ambientales (Arias, V. 2006).
Por otro lado, la caracterización teórica para determinar la solubilidad y ocurrencia química de los compuestos sulfurados de cobre, se puede resumir en las siguientes ecuaciones:
Reacción de la Covelina (CuS):
CuS + Fe(S2O4)3 → CuSO4 + 2FeSO4 + S0
Reacción de la Calcosina (Cu2S) en medio ácido:
Cu2S + 2Fe2(SO4)3 → 2CuSO4 + 4FeSO4 + S0
Reacción de la Bornita (Cu5FeS4):
Cu5FeS4 + 5Fe2(SO4)3+ H2SO4 + ½ O2 → 5CuSO4 + 11FeSO4 + H2O + 4S0
Prácticamente todo el cobre de la bornita se puede disolver con ácido en caliente, más sulfato férrico. Las reacciones son semejantes a lo que ocurre con la calcosina.
Reacción de la Calcopirita (CuFeS2):
2 CuFeS2 + 17/2 O2 + H2SO4 → 2 CuSO4 + Fe2(SO4)3 + H2O
CuFeS2 + 2Fe2(SO4)3 + 2H2O + 3O2 → CuSO4 + 5FeSO4 + 2H2SO4
La calcopirita es una especie más refractaria y su reacción es poco favorecida en medio ácido. Se observa mayor facilidad de transformar los sulfuros ricos en cobre (Cu2S) con respecto a los pobres (CuFeS2), dado el mayor consumo de oxígeno (Butler, J. 1988). Durante la electrólisis de cobre en medio ácido, el potencial de equilibrio de la reacción de cobre iónico a cobre metálico se produce en medio ácido pasando de un potencial positivo a negativo (M. Pourbaix, 1997).
Los métodos electródicos en la reducción de impurezas permiten obtener disoluciones con impurezas del orden de 10-6 moles/litro en tiempos suficientemente prolongados mediante el uso de electrodos auxiliares (J. Bockris y A. Reddy, 1996). La observación de los detalles para la obtención de resultados se traduce en la competencia y presencia de las impurezas (Habashi, F. 1979). La disolución conteniendo impurezas hasta una concentración de c moles por m3 y considerando que el volumen total de la disolución es de V cm3, esta disminución del número de moles en solución debe satisfacer la siguiente relación:
dVc/dt = -iimpA/nF
Mediante un proceso de difusión a la densidad de corriente límite, se tendrá:
Ct = Co e-(DA/δV)t
Con Co y Ct en concentración de impurezas en el momento inicial y en la etapa final del proceso (Sánchez, M. 1991).
III. MÉTODO EXPERIMENTAL
La metodología fue experimental y según los objetivos planteados inicialmente, se pretende generar alternativas de procesos y luego evaluarlas. Todo ello a nivel teórico está apoyado por los datos bibliográficos experimentales (Krauskopf, K. 1995).
Si bien es cierto que el tratamiento de efluentes involucra efectuar procesos de pretratamientos y/o tratamientos primarios de separación sólido-líquido, seguido de operaciones unitarias como neutralización, precipitación y extracción. Dependiendo del destino que se le dará a los efluentes materia de tratamiento, se optó por:
1. Identificación de especies mineralógicas
2. Determinar el mecanismo de la lixiviación con H2SO4
3. Efectuar análisis de contenido metálico
4. Electroobtención de impurezas
5. Interpretación de resultados.
3.1. Especies mineralógicas
La caracterización de un mineral con abundante constitución de sulfuros permite identificar las especies descritas anteriormente.
3.2. Lixiviación con solución de ácido sulfúrico
La lixiviación se desarrolló bajo condiciones semi estandarizadas a nivel industrial, obteniéndose resultados concordantes a la naturaleza del mineral.
Las condiciones que favorecieron la disolución:
a) Un pH entre 1,5 y 3,5
b) Temperatura ambiente 18 ºC
c) Agitación en botellas, oxigenación limitada
3.3. Análisis de contenido metálico
La enargita constituye una mena de cobre (pórfidos cupríferos y epitermales de Au-Ag). La solubilización de las formas sulfuradas de arsénico no es fácil. La reacción fundamental en medio ácido es:
4 FeAsS + 13 O2 + 6 H2O → 4 H3AsO4 + 4 FeSO4
Si además hay pirita en la mena, entonces el sulfato férrico producido actuará de la siguiente manera, coadyuvando a la oxidación-lixiviación del arsénico:
2 FeAsS + Fe2(SO4)3 → 2 H3AsO4 + 4 FeSO4 + H2SO4
El análisis químico cuantitativo por la técnica de ICP determina la composición de la muestra de cabeza y del residuo sólido remanente del proceso de lixiviación, predominando los contenidos de hierro, cobre, plata, plomo y zinc.
El contenido de elementos en el drenaje de proceso, que comúnmente se conoce como solución rica, o solución descarte, dependiendo de la etapa, toma importancia teniendo en cuenta la implicancia o impacto al medio ambiente. En el presente estudio, el contenido de elementos en la solución rica se determinó por diferencia simple a partir del mineral de cabeza y el residuo sólido.
3.4. Electroobtención de impurezas
Habiendo agotado el electrolito principal, el cobre, la solución efluente residual es sometida al agotamiento mediante electrodos auxiliares de acero inoxidable, permitiendo la separación a tiempos prolongados y a voltajes inferiores a la electrodeposición del cobre.
IV. ANÁLISIS Y DISCUSIÓN
Las menas oxidadas son muy solubles en H2SO4 diluido. La tasa de disolución depende del tipo de lixiviación y de las condiciones de contacto con la mena. Los factores que favorecen son la tasa de concentración del H2SO4, mayores superficies de contacto (mayor granulometría) y en lo posible una buena agitación.
Los sulfuros son poco solubles en H2SO4 a menos que la condición de oxidación sea fuertemente provista (presión de oxígeno permite que el cobre lo capte y se solubilice). Las reacciones son controladas por factores externos como la temperatura y/o la adición de reactivos fuertemente oxidantes.
La concentración metálica y el análisis de viabilidad determinará si los materiales (minerales valiosos) son sometidos al tratamiento pirometalúrgico secuencial a fin de obtener un producto con ventaja comercial.